Trong loạt bài “Lời hứa và hiểm hoạ: Những vấn đề đáng báo động về vaccine COVID-19 mRNA”, chúng ta sẽ tìm hiểu những thiếu sót trong quy trình đánh giá công nghệ mRNA. Chính sự thiếu sót này đã tạo tiền đề cho những tác phụ dụng nghiệm trọng liên quan đến các thành phần chưa được kiểm tra độ an toàn như hạt nano lipid , protein gai, những tạp chất như DNA và lipid cũng như phân tử mRNA đã được chỉnh sửa.
Lời hứa và hiểm họa: Những vấn đề đáng báo động về vaccine COVID-19 mRNA (Phần 3)
Quá trình kiểm tra không chặt chẽ và những tác động của hạt nano lipid vận chuyển phân tử mRNA có thể giải thích một số tác dụng phụ.
Trong hai phần trước chúng ta đã thảo luận việc FDA nới lỏng các quy định về công nghệ mRNA đối với vaccine mRNA và những dữ liệu cho thấy lớp vỏ hạt nano lipid (LNP) sẽ phân bố khắp cơ thể trong các thử nghiệm trên động vật. Tuy nhiên thử nghiệm về phân phối sinh học của LNP vẫn chưa được thực hiện trên người, đồng thời chúng ta cũng thiếu các dữ liệu về phân phối sinh học của phân tử mRNA trong vaccine và protein gai do phân tử này mã hóa. Trong phần này chúng ta sẽ tiếp tục thảo luận về cấu tạo của LNP và tác động của chất này đến cơ thể.
Nếu lớp vỏ LNP quá bền vững, lớp vỏ này sẽ không thể phân hủy tại chỗ tiêm như dự kiến và có thể di chuyển đến nhiều cơ quan trên khắp cơ thể. Những đặc điểm khác như điện tích và xu hướng ngưng kết của LNP cũng ảnh hưởng đến khả năng xuất hiện tác dụng phụ.
Tóm tắt nội dung
- Lớp vỏ hạt nano lipid (LNP) chứa phân tử RNA thông tin (mRNA) hoạt hóa.
- LNP do các hạt lipid “kết hợp” với nhau để tạo thành một khối cầu.
- Các phân tử LNP có khả năng vận chuyển mRNA, tuy nhiên, cấu trúc này cũng có thể gây hại cho cơ thể.
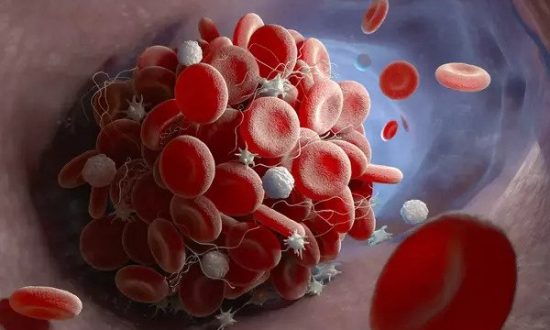
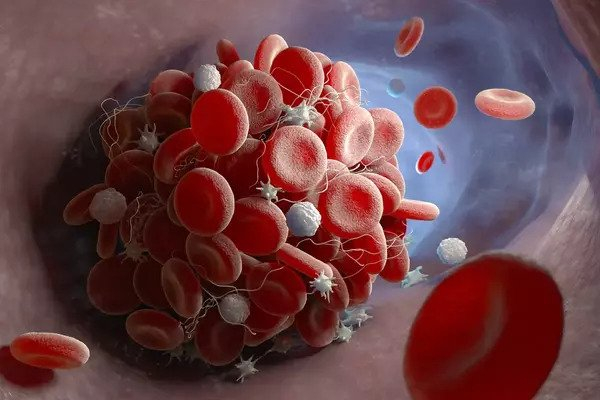
- Lớp vỏ LNP có thể ngưng kết với nhau hoặc vỡ ra sau khi tiêm vào cơ thể, tạo thành cục máu đông.
- Nếu lớp vỏ LNP bị vỡ, các sợi mRNA sẽ di chuyển tự do trong máu.
- Vì các phân tử mRNA tích điện tích âm nên khi ngưng kết với các phân tử có điện tích dương, mRNA có kích hoạt quá trình đông máu.
- Lipid trong lớp vỏ LNP cũng có khả năng kích hoạt quá trình đông máu hoặc gây đáp ứng miễn dịch quá mức.
- Các nhà nghiên cứu đã biết trước những vấn đề này từ trước khi vaccine được cấp phép.
- Các cơ quan quản lý đã biết được khả năng gây hại của vaccine từ trước khi bắt đầu chương trình tiêm chủng.
- Khả năng gây hại của các mũi vaccine tăng cường cũng đã được biết trước khi cấp phép.
- Sau một thời gian, chúng ta đang dần hiểu hơn về các cơ chế gây ra tác dụng phụ.
Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) và Cơ quan Dược phẩm Châu Âu (EMA) đã cấp phép sử dụng một loại vaccine mới ở người chỉ dựa vào các nghiên cứu trong phòng thí nghiệm và trên mô hình động vật. Ngoài ra, hầu hết các nghiên cứu về mRNA được tiến hành trước đại dịch COVID-19 đều sử dụng phương pháp tiêm trực tiếp vào máu qua đường tĩnh mạch (IV) chứ không phải bằng đường sử dụng thường dùng của các loại vaccine là tiêm bắp (IM).
Có rất nhiều khó khăn để thiết kế một loại vaccine dựa trên loại công nghệ đang được ứng dụng điều trị ung thư như công nghệ mRNA, một số ưu điểm của LNP có thể là những yếu tố góp phần gây ra tác dụng phụ.
Đặc điểm thiết kế của LNP
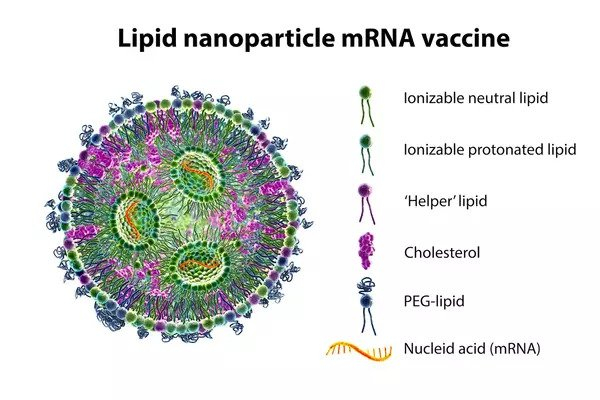
LNP là một cấu trúc nang gồm có bốn loại lipid khác nhau chứa phân tử mRNA bên trong.
Chúng ta hãy tưởng tượng khi một giọt dầu rơi vào cốc nước, các phân tử dầu sẽ không phân tán ra mà dính vào nhau. Đó chính là cơ chế các phân tử LNP kết hợp với nhau để vận chuyển phân tử mRNA đến màng tế bào, nơi sẽ hấp thụ phân tử mRNA.
Một số đặc tính của lipid khiến những phân tử nano lipid gắn kết với nhau thành dạng viên nang LNP. Đuôi của phân tử lipid kỵ nước (không hòa tan trong nước) không mang điện tích. Phần đầu của phân tử lipid là photphat có mang điện tích nên có tính ưa nước. Những đặc điểm này khiến các phân tử lipid này có thể tự tổ chức gắn kết với nhau.
Các phân tử lipid sẽ tập hợp lại với phần đuôi kỵ nước hướng vào trong và phần đầu ưa nước hướng ra ngoài—tạo thành một dạng hình cầu, như hình bên dưới. Khi polyethylen glycol (PEG) gắn vào phân tử lipid, PEG-lipid sẽ giúp tăng tính ổn định phân tử, giúp tạo thành các vỏ LNP có kích thước nhỏ hơn và ngăn LNP không dính vào các phân tử protein trong máu.
Ở phần trung tâm của lớp vỏ LNP là phân tử RNA mang điện tích âm. Khi cộng điện tích âm của RNA và điện tích dương của đầu photphat trên phân tử lipid, điện tích chung của LNP phần lớn là trung tính, chính xác hơn là hơi âm.
-

- Hình minh họa 3D cho thấy mặt cắt ngang của hạt nano lipid mang phân tử mRNA của virus (màu cam). (Kateryna Kon/Shutterstock)
PEG-lipid giúp giữ lớp vỏ LNP không bị vỡ ra. Tuy nhiên, khi ở trong tế bào, lớp vỏ này cần phải tách ra để giải phóng phân tử mRNA. Cấu trúc hình nón của LNP sẽ thực hiện chức năng này.
Lượng PEG-lipid có thể ảnh hưởng đến kích thước của các hạt nanolipid và điện thế zeta. Điện thế zeta là điện tích xung quanh bề mặt của hạt nanolipid. Điện thế zeta có vai trò rất quan trọng vì đây là yếu tố quyết định sự phân tán hay tụ lại của các nang LNP. Điện thế zeta cao— dù dương hay âm— đều sẽ giúp các hạt nano lipid phân tán và trôi tự do.
Ngoài ra, một số loại PEG chỉnh sửa có thể ảnh hưởng đến tốc độ đào thải LNP của thận và hệ miễn dịch. Khi thời gian đào thải LNP kéo dài hơn, những nang này sẽ lưu thông trong máu lâu hơn và có khả năng gây ra tác dụng phụ.
Những vấn đề nan giải trong thiết kế của LNP: Tính ổn định hay tính dễ vỡ
Vấn đề nan giải trong thiết kế của lớp vỏ LNP có những tác động nghiêm trọng, đó là: nên tạo ra một lớp vỏ LNP ổn định, khó vỡ hay là một lớp vỏ yếu, có thể phân giải nhanh chóng. Thiết kế này có thể ảnh hưởng đến hoạt động của lớp vỏ trong cơ thể như thế nào.
Dạng nang có độ ổn định cao thường được dùng trong liệu pháp gen mRNA. Đây là chính đặc điểm của công nghệ này. Trong liệu pháp gen, mRNA cần phải đủ ổn định để đạt được mục tiêu. Đó là có thể tạo ra loại protein bị thiếu hoặc bất hoạt các gen gây hại.
Tuy nhiên, vaccine cần phải có đặc điểm ngược lại: lớp vỏ LNP cần phải kém ổn định hơn để có thể nhanh chóng phân giải tại chỗ tiêm và giải phóng phân tử mRNA ngay lập tức. Nếu không, lớp vỏ LNP sẽ di chuyển khắp cơ thể, đến các mô và cơ quan không mong muốn.
Các nghiên cứu về phân bố sinh học đã được trình bày trong Phần 1 và 2 cho rằng thiết kế của LNP mRNA đã thất bại khi thực hiện "nhiệm vụ kép bất khả thi" này. Sự phân tán đến các cơ quan ở xa vị trí tiêm đạt mức cao nhất trong khoảng 48 giờ. Tác động của ứng xử của protein gai lên tế bào ở những cơ quan này vẫn chưa được hiểu rõ. Vì vậy, việc sử dụng LNP được thiết kế đối với liệu pháp gen cho vaccine mRNA có thể sẽ là một sai lầm nghiêm trọng.
Đặc điểm thiết kế của LNP ảnh hưởng đến quá trình đông máu
Ngoài khó khăn khi phải tạo ra một lớp vỏ LNP vừa ổn định, vừa phân giải nhanh chóng tại vị trí tiêm, thiết kế LNP cũng có thể dẫn đến tình trạng kết tụ, kích hoạt quá trình đông máu. Nếu lớp vỏ LNP bị vỡ ra, điện tích trên phân tử lipid và mRNA có thể tạo nên quá trình tương tác với các chất khác trong máu.
Hai yếu tố này có thể giải thích hiện tượng "huyết khối tắc mạch". Những hiện tượng liên quan đến sự hình thành huyết khối trong máu. Khi cục máu đông hình thành và di chuyển đến những vị trí khác (thuyên tắc) có thể làm tắc nghẽn mạch máu.
LNP có thể ngưng tụ và gây ra đông máu
Khi lớp vỏ LNP khuếch tán vào máu, những hạt nhỏ này có thể gia tăng kích thước do hiện tượng Ostwald ripening (Ostwald ripening phenomenon). Đó là quá trình các tinh thể nhỏ hòa tan trong dung dịch và sau đó lắng đọng lại, tạo thành các cụm lớn hơn.
Đường kính của tiểu động mạch (các mạch máu nhỏ nối giữa động mạch và mao mạch) nằm trong khoảng từ 8000 đến 60.000 nanomet (nm). Các nang LNP trong vaccine mRNA COVID-19 có kích thước khoảng 60 đến 200 nm. Nếu các hạt mRNA LNP kết cụm với nhau và tăng kích thước lên đến 5000 nm trở lên, LNP có thể làm thuyên tắc mạch máu.
Khi có huyết khối trong mạch máu, lưu lượng máu đến các cơ quan quan trọng có thể giảm đi. Những cơ quan quan trọng gồm có tim, phổi, thận, ruột và cả não.
Ví dụ: khi khám nghiệm tử thi 25 trường hợp đột tử trong vòng 20 ngày sau khi tiêm vaccine COVID-19 đã phát hiện được 8 trường hợp có biến cố huyết khối, trong đó có 5 trường hợp bị "nhồi máu cơ tim", 2 trường hợp bị "thuyên tắc phổi" và một trường hợp có "huyết khối tĩnh mạch sâu". (pdf)
Đã có các nghiên cứu đánh giá mức độ ngưng tụ LNP trên người hay chưa? Theo chúng tôi được biết, hiện tại vẫn chưa có nghiên cứu nào như thế được công bố.
Lớp vỏ LNP có thể vỡ ra
Nếu lớp vỏ LNP bị vỡ ra thì hai thành phần lipid và mRNA có thể tương tác và gây đông máu do mỗi thành phần này đều mang điện tích.
Điện tích sẽ tham gia định hướng quá trình di chuyển của những thành phần này trong cơ thể. Ví dụ, trong các nghiên cứu phân phối sinh học tiền lâm sàng, phần vỏ nang LNP tích điện dương có thể hướng đến phổi; phần LNP tích điện âm sẽ hướng đến lá lách; trong khi LNP mang điện tích trung tính (ví dụ như vaccine mRNA COVID-19) có xu hướng di chuyển đến gan nhiều hơn.
Tính chất tích điện âm của phân tử mRNA tự do cũng gây ra nhiều vấn đề ở loại vaccine sử dụng vectơ adenovirus do AstraZeneca và Johnson & Johnson. Hai loại vaccine này gây ra huyết khối ở một số người có đặc điểm di truyền nhất định
Tương tự, nếu phân tử mRNA tích điện âm thoát ra khỏi lớp vỏ LNP, về mặt lý thuyết phân tử này có thể gây đông máu do có điện tích âm.
Liệu những khó khăn khi duy trì "quy trình lạnh" nghiêm ngặt (nhiệt độ thấp để đảm bảo độ ổn định của vaccine từ khi sản xuất đến khi tiêm vào cơ thể) có khả năng khiến LNP bị phân hủy trước khi tiêm hay không?
Theo nhà tư vấn công nghệ sinh học Christie Grace: “Khi LNP được làm đông và rã đông, [mRNA] có thể thoát ra ngoài, điện tích của phân tử này có thể tương tác với cơ thể người và [có khả năng] gây ra huyết khối”.
Bác sĩ Ko, một giáo sư dược học người Hàn Quốc, đã viết hàng chục bài báo về lớp vỏ LNP. Vị bác sĩ này cho rằng lớp vỏ LNP có thể bị phá vỡ và tan rã nếu độ pH và nhiệt độ không được kiểm soát cẩn thận.
Điều gì sẽ xảy ra nếu lớp vỏ LNP phân hủy trong lọ vaccine trước khi tiêm? Có thử nghiệm nào đánh giá sự tương tác của phân tử mRNA khi tiếp xúc với máu hay không (không phải là phân tử mRNA được lớp vỏ nano lipid bao bọc)?
Thiết kế LNP có thể tác động đến quá trình đông máu
Sự tương tác của các hạt nano có thể có lợi và cũng có thể có hại. Ví dụ, có thể thiết kế các hạt nano lipid để kích hoạt quá trình đông máu. Đặc điểm này có lợi cho những người bị rối loạn đông máu. Tuy nhiên, nếu lớp vỏ LNP tương tác với các chất trong máu gây ra huyết khối thì lại gây hại.
Trước đại dịch, chúng ta đã biết gì về khả năng gây đông máu của LNP?
Vào năm 2020, Faizullin và cộng sự đã báo cáo rằng: “Chúng tôi đã quan sát được những thay đổi rõ rệt về cả hình thái cục máu đông và động học của quá trình đông máu fibrin khi có sự hiện diện của liposome nhân tạo”. Nói cách khác, các nghiên cứu trước đây về LNP cho thấy rằng cục máu đông và quá trình hoạt động của fibrin sẽ thay đổi khi có mặt LNP.
Fibrin là một phần của dòng thác đông máu tự nhiên. Những chất liên kết với fibrin sẽ làm tăng tốc quá trình đông máu bình thường. Quá trình đông máu fibrin xảy ra nhanh hơn trong các nghiên cứu ở phòng thí nghiệm sử dụng máu của bệnh nhân mắc COVID-19.
Đặc điểm đông máu này có thể là do sự hiện diện của tiểu đơn vị S1 từ protein gai. Do đó, LNP của vaccine mRNA có thể thúc đẩy quá trình đông máu do đặc điểm thiết kế của LNP hoặc do sự có mặt của tiểu đơn vị S1 protein gai hoặc cả hai yếu tố trên.
'Kích thích miễn dịch quá mức'
Cuối cùng, mRNA được thiết kế để vượt qua hệ miễn dịch tự nhiên của chúng ta. Thiết kế thông minh này có thể tạo ra một lỗ hổng nghiêm trọng.
Hệ miễn dịch của chúng ta sẽ rà soát một số thành phần đặc biệt để phát hiện sự xâm nhập của vi khuẩn. Một trong những thành phần này là các phân tử RNA ngoại lai. Để tránh bị cơ thể phát hiện trước khi phát huy tác dụng, một thành phần của phân tử mRNA trong vaccine Covid-19 thay uridine bằng N1-methylpseudouridine.
Tuy nhiên, nếu hệ thống miễn dịch không thể phát hiện phân tử này thì vaccine sẽ không có tác dụng. Một số tá dược, ví dụ như nhôm, sẽ được thêm vào với mục đích đánh thức miễn dịch. Sau khi được kích thích, hệ miễn dịch sẽ tăng cường sản xuất kháng thể và tế bào T nhớ.
Các phân tử lipid trong lớp vỏ LNP cũng có thể kích thích hệ miễn dịch thông qua dấu hiệu để cơ thể phát hiện. Mặc dù tính chất này có thể khiến phân tử lipid trở thành chất bổ trợ hiệu quả cho vaccine, nhưng thử nghiệm trên mô hình chuột cho thấy LNP có thể khiến hệ thống miễn dịch rơi vào tình trạng “quá mức".
EMA lưu ý trong báo cáo rằng hệ thống miễn dịch bẩm sinh sẽ được kích hoạt ngay sau khi tiêm vaccine, đạt cực đại sau 6 giờ và quay lại mức bình thường sau 9 ngày. Một bài báo trên tạp chí Cell cũng thảo luận về hệ thống miễn dịch bẩm sinh trong các tác dụng phụ của vaccine (AE). Các tác giả lưu ý rằng “thường xuyên tiêm mũi vaccine tăng cường có thể làm tăng tần suất và/hoặc mức độ nghiêm trọng của các tác dụng phụ”.
Những điều gì đã biết trước khi cấp phép cho vaccine mRNA?
Trước khi vaccine ngừa COVID-19 được cấp phép, nhiều nghiên cứu về LNP trước đó đã thể hiện rõ các vấn đề sau:
1) Hướng di chuyển (Off-target travel) trong cơ thể của LNP do điện tích của phân tử này quyết định.
2) Hệ miễn dịch bẩm sinh được lớp vỏ LNP kích hoạt (innate immune system is triggered) có nguy cơ tạo ra phản ứng miễn dịch quá mức.
3) Các hạt lipid cation (tích điện dương) - cationic (positively charged) lipid particles - có liên quan đến kích thích miễn dịch.
4) Phương thức chích ngừa (qua cơ hoặc máu) có ảnh hưởng đến sự di chuyển của LNP.
5) Lớp vỏ LNP được thiết kế đặc biệt để được hấp thu qua hệ bạch huyết (lymphatic system). Điều này đã được thảo luận trong một bài viết khác của The Epoch Times.
Đây là những đặc điểm chúng ta đã biết trước khi FDA cấp phép cho vaccine mRNA. Những đặc điểm này cũng thể hiện rõ ràng rằng cần thực hiện nhiều thử nghiệm ở người hơn.
Carrasco và cộng sự cũng đồng tình với những lo ngại của chúng tôi, đó là cần phải hiểu rõ hơn về quá trình phân bố sinh học của những thành phần này ở người. Nhóm nghiên cứu này lưu ý rằng: “Một giá trị cụ thể và quan trọng của những hiểu biết mới này là tìm cách giảm sự phân bố có hệ thống và quá trình di chuyển ra ngoài mục tiêu của vaccine khi tiêm bắp”.
Những hiểu biết về sự di chuyển khắp cơ thể của các hạt điện tích vẫn còn rất hạn chế và chủ yếu là dựa vào đường tiêm tĩnh mạch (IV); chỉ có một nghiên cứu trước đại dịch tìm hiểu sự phân tán LNP qua đường tiêm bắp.
Một bài báo trên tạp chí Nature năm 2021 đã tóm tắt tầm quan trọng của việc thiết kế vaccine. Cũng như EMA, nhóm nghiên cứu này lưu ý rằng lớp vỏ LNP tích điện âm tập trung ở gan sau khi tiêm. "Sự xuất hiện ngoài mục tiêu có tính hệ thống không mong muốn này của vaccine mRNA-LNP có thể sẽ giảm đi nhờ thiết kế thích hợp lớp vỏ LNP và phân tử lipid ion hóa".
Khi vén bức màn về thiết kế của LNP, chúng ta thấy rằng có một số đặc điểm nhằm mục đích đưa mRNA đến tế bào, từ đó đã tạo tiền đề cho một loạt các tác dụng phụ có thể dự đoán thông qua những thử nghiệm và có thể ngăn chặn nhờ những chính sách nghiêm ngặt.
(Còn nữa)
Tiếp theo: Trong Phần 4, chúng ta sẽ thảo luận về thành phần chứa trong lớp vỏ LNP—mRNA và protein gai do phân tử này mã hóa. Chúng tôi cũng đi sâu vào cơ chế protein gai và tiểu đơn vị S1 tác động đến hệ tim mạch và các nghiên cứu gần đây cho thấy đáp ứng miễn dịch tự nhiên (cytokine) hoạt động quá mức gây ra viêm cơ tim như thế nào. Mặc dù FDA đã thừa nhận rằng hoạt động giám sát thụ động là không đủ để nghiên cứu các tác dụng phụ, nhưng nghiên cứu sau khi đưa thuốc ra thị trường bắt buộc thực hiện đã quá hạn hơn sáu tháng.
Theo The Epoch Times
Đức Nhân biên dịch
Bài viết này chỉ thể hiện quan điểm của nhóm tác giả, không nhất thiết phản ánh quan điểm của NTDVN.
Lời hứa và hiểm họa: Những vấn đề đáng báo động về vaccine COVID-19 mRNA (Phần 1)
Lời hứa và hiểm họa: Những vấn đề đáng báo động về vaccine COVID-19 mRNA (Phần 2)
Các tác giả: Allison Krug, Dr. Ram Duriseti, Xiaoxu Sean Lin and Yuhong Dong
Allison Krug là một nhà dịch tễ học và một nhà quản lý dự án có kinh nghiệm thực hiện các chương trình y tế dân số. Cô là tác giả chính trong nghiên cứu phân tích rủi ro-lợi ích phân tầng đầu tiên của việc tiêm vaccine mRNA ở thanh thiếu niên và là biên tập viên cho hơn 400 bài báo nghiên cứu được xuất bản trên các tạp chí được bình duyệt và có hệ số tác động cao. Cô cũng là người sáng lập và giám đốc điều hành của Artemis Biomedical Communications, LLC