Một loại thuốc được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ phê duyệt, thậm chí được ca ngợi là phương pháp điều trị đột phá đầu tiên cho nguyên nhân hàng đầu gây mù lòa, đã khiến một số bệnh nhân bị mù, gây ra báo động về các tác dụng phụ khó lường của thuốc.
Tác động tiềm năng
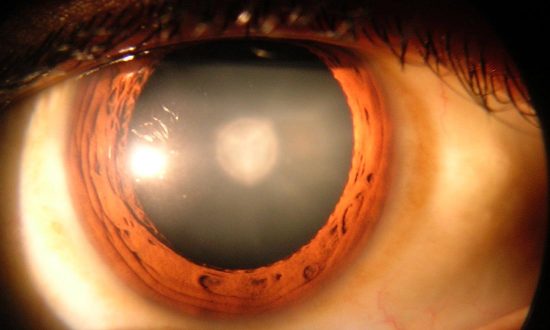
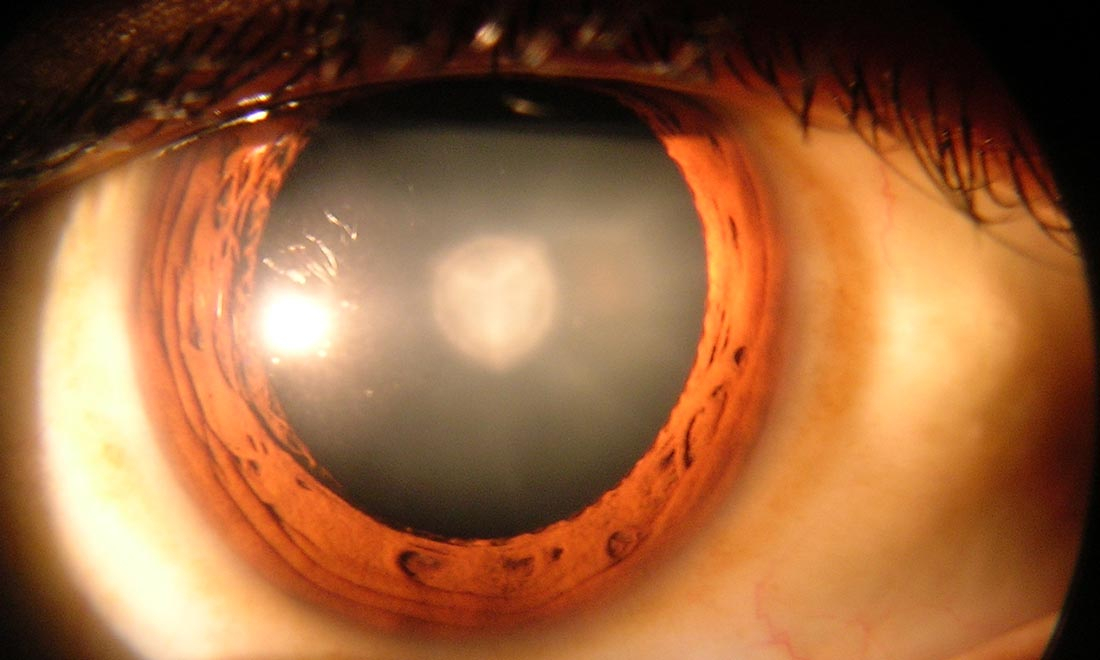
Vào tháng Hai, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt một loại thuốc mới có tên gọi Syfovre (thuốc tiêm pegcetacoplan), để điều trị bệnh teo địa lý, một dạng tiến triển của thoái hóa điểm vàng liên quan đến lão hoá có thể dẫn đến mù lòa.
Loại thuốc này ban đầu được ca ngợi là một bước đột phá trong cuộc chiến chống lại tình trạng không thể chữa trị trước đây, có ảnh hưởng xấp xỉ 1 trên 100 người Mỹ ngoài 50 tuổi.
Tiến sĩ Eleonora Lad, điều tra viên chính của nghiên cứu OAKS - được tài trợ bởi Apellis Pharmaceuticals, Inc. (công ty sản xuất Syfovre), kiêm giám đốc nghiên cứu lâm sàng nhãn khoa tại Trung tâm Y tế Đại học Duke, cho biết trong một tuyên bố vào thời điểm đó: “Sự chấp thuận của Syfovre là sự kiện quan trọng nhất trong nhãn khoa võng mạc trong hơn một thập kỷ”.
Tuy nhiên, sự phấn khích chuyển sang lo lắng khi các trường hợp viêm mắt nặng và mất thị lực xuất hiện sau khi thuốc ra mắt.
Hiệp hội Chuyên gia Võng mạc Hoa Kỳ, tổ chức chuyên gia về võng mạc lớn nhất thế giới, đã đưa ra một thông báo an toàn sau khi các bác sĩ báo cáo nhiều trường hợp viêm mạch máu võng mạc do tắc (ORV), một loại viêm nghiêm trọng có khả năng gây mù làm cản trở lưu lượng máu trong các mạch nuôi dưỡng võng mạc, Biopharma Dive báo cáo.
Trong số sáu trường hợp đầu tiên được báo cáo, năm bệnh nhân bị mù bên mắt được điều trị và một phụ nữ bị mù hoàn toàn sau khi dùng Syfovre ở cả hai mắt.
Có một trường hợp nghi ngờ thứ tám liên quan đến ORV vẫn chưa được xác nhận, theo tin tức của Stat.
Phản hồi
Những tác dụng phụ này không được thấy trong các thử nghiệm lâm sàng, đặt ra câu hỏi về hồ sơ an toàn của thuốc.
Đáp lại các trường hợp ORV được báo cáo, công ty Apellis đã công bố một thông cáo báo chí, trong đó nói rằng không có dấu hiệu nào cho thấy “các vấn đề về sản phẩm hoặc sản xuất thuốc” góp phần gây ra tác dụng phụ hiếm gặp nhưng nghiêm trọng.
Nhà sản xuất thuốc chưa xác định được nguyên nhân gốc rễ nhưng đã xác nhận ít nhất 7 trường hợp không tắc/tắc trong số 68.000 bệnh nhân đầu tiên được điều trị kể từ khi Syfovre ra mắt vào tháng Hai.
Theo Appellis, trong suốt hơn 23.000 mũi tiêm thử nghiệm lâm sàng, không có trường hợp nào được báo cáo về tình trạng này. Không có thay đổi nào được thực hiện đối với công thức thuốc giữa các thử nghiệm lâm sàng Giai đoạn III và việc phát hành thương mại vật tư.
Các phản ứng bất lợi thường gặp nhất đối với Syfovre bao gồm khó chịu ở mắt, thoái hóa điểm vàng liên quan đến tuổi tác, dịch kính nổi và xuất huyết kết mạc, theo thông tin kê đơn.
Sau báo cáo về tác dụng phụ nghiêm trọng, Apellis tiết lộ dữ liệu từ một nghiên cứu mở rộng cho Syfovre, bao gồm 30 tháng điều trị liên tục. Theo công ty, dữ liệu “củng cố” tính hiệu quả và an toàn lâu dài của thuốc.
Theo George Citroner - The Epoch Times
Bảo Vy biên dịch