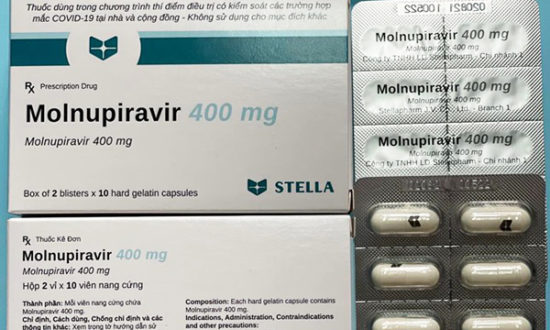
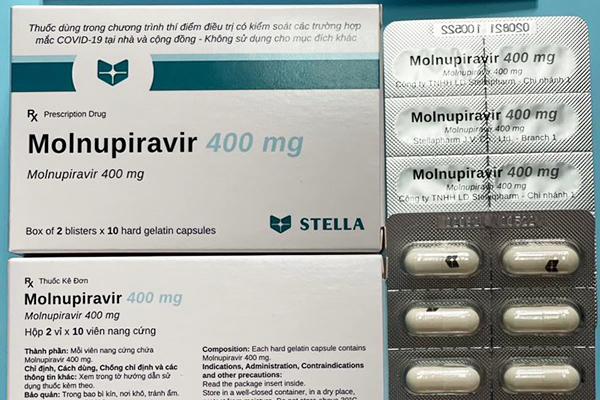
Ba loại thuốc chứa Molnupiravir do 3 công ty Việt Nam sản xuất vừa được Cục Quản lý Dược (Bộ Y tế) cấp giấy đăng ký lưu hành tại Việt Nam.
Ngày 17/2, Cục Quản lý Dược (Bộ Y tế) vừa cấp giấy phép đăng ký lưu hành cho 3 loại thuốc:
- Molravir 400: có hàm lượng Molnupiravir 400mg, dạng viên nang cứng, tuổi thọ 6 tháng, do Công ty Cổ phần Dược phẩm Boston Việt Nam sản xuất.
- Movinavir: có hàm lượng 200mg Molnupiravir, dạng viên nang cứng, tuổi thọ 6 tháng, do Công ty Cổ phần Hóa dược phẩm Mekophar sản xuất
- Molnuporavir Stella 400: Hàm lượng 400mg Molnupiravir, dạng viện nang cứng, tuổi thọ 8 tháng, do Công ty TNHH Liên doanh Stellapharm – chi nhánh 1 sản xuất.
Theo Cục Quản lý Dược, đây là ba công ty trong nước đầu tiên được cấp phép sản xuất thuốc kháng virus điều trị bệnh nhân COVID-19.
Ba điều kiện đi kèm với đề xuất cấp phép khẩn cấp là:
- Doanh nghiệp phải kiểm tra chất lượng nguyên liệu đạt yêu cầu trước khi sản xuất;
- Tiếp tục theo dõi, kiểm tra chất lượng thuốc hàng tháng sau khi được cấp giấy đăng ký lưu hành;
- Tiếp tục nghiên cứu độ ổn định của thuốc và nộp dữ liệu nghiên cứu, hồ sơ cập nhật hạn dùng để thẩm định theo yêu cầu của Bộ hồ sơ kỹ thuật chung ASEAN.
Cục Quản lý Dược yêu cầu, sau khi được cấp phép có điều kiện, ba công ty sản xuất thuốc trong nước sẽ phối hợp với các cơ sở điều trị thực hiện đúng các quy định hiện hành về thuốc kê đơn, theo dõi an toàn, hiệu quả, tác dụng không mong muốn của thuốc kháng virus trên người Việt Nam và tổng hợp, báo cáo theo quy định tại Thông tư số 32/2018/TT-BYT.
Các đơn vị sản xuất phải kê khai giá thuốc và được thẩm định giá bởi cơ quan quản lý. Giá bán dự kiến thấp hơn nhiều so với nhập khẩu.
Molnupiravir là hoạt chất có tác dụng kháng virus, được xem là "vũ khí" quan trọng trong điều trị F0 tại nhà. Thuốc có tác dụng giảm tải lượng virus khi sử dụng ở giai đoạn đầu mắc bệnh, từ đó giảm nguy cơ trở nặng và tử vong. Thuốc có dạng viên, được dùng theo đường uống, thuận tiện cho F0 điều trị tại nhà.
Tính đến ngày 21/1/2022, Bộ Y tế đã phân bổ khoảng 450.000 liều thuốc Molnupiravir cho Chương trình thí điểm điều trị có kiểm soát các trường hợp mắc COVID-19 thể nhẹ. Chương trình được thực hiện tại TP. HCM từ giữa tháng 8/2021 và đã mở rộng ra 53 địa phương có dịch.
Theo kết quả thử nghiệm tại 22 tỉnh, thành do Bộ Y tế công bố hồi tháng 11/2021, thuốc có tính an toàn cao, dung nạp tốt, hiệu quả rõ rệt về giảm tải lượng virus, giảm lây lan, tỷ lệ chuyển nặng rất thấp, rút ngắn thời gian điều trị và không có ca nào dẫn đến tử vong.
Theo Bộ Y tế, để đảm bảo an toàn, hiệu quả, bệnh nhân chỉ sử dụng thuốc Molnupiravir khi có đơn của bác sĩ theo đúng chỉ định, các giới hạn sử dụng và các cảnh báo, thận trọng của thuốc. Không tự ý mua, sử dụng thuốc Molnupiravir trôi nổi, không rõ nguồn gốc, xuất xứ trên thị trường. Trong quá trình sử dụng thuốc Molnupiravir, nếu gặp phải bất kỳ phản ứng có hại nào của thuốc, cần thông báo ngay cho bác sỹ hoặc dược sỹ để được tư vấn và xử trí kịp thời.
Minh Nguyệt