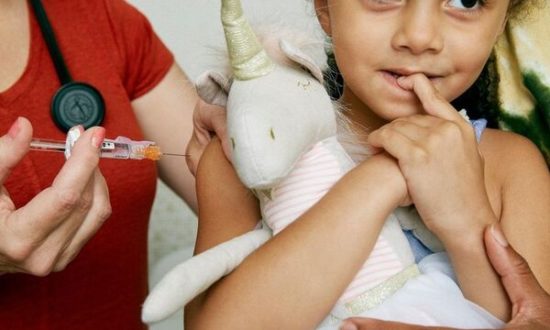
Hôm thứ Sáu (11/2/2022), Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đột ngột thông báo tạm dừng kế hoạch phê duyệt liều tiêm vaccine COVID-19 thứ 3 cho trẻ dưới 5 tuổi. Thời gian xem xét sẽ kéo dài thêm một tháng nữa khi các dữ liệu Pfizer đầy đủ hơn. Hãng tin AP vốn hết sức thất vọng vì 'vaccine chưa được phê duyệt cho trẻ dưới 5 tuổi', cho rằng đây là một 'động thái hết sức bất thường' của FDA.
Theo tin từ AP, FDA yêu cầu Pfizer nộp hồ sơ để xem xét phê duyệt vacccine 2 hoặc 3 liều tiêm cho trẻ từ 6 tháng tới 5 tuổi. Theo khẳng định của Pfizer, liều vaccine 3 mũi sẽ an toàn cho trẻ trong đại dịch. Tuy nhiên, tiến trình này đột ngột bị trì hoãn vào hôm qua, thứ Sáu ngày 11/2/2022.
FDA cho biết họ phải chờ dữ liệu và mức độ hiệu quả của mũi tiêm thứ ba đối với nhóm trẻ có độ tuổi từ 6 tháng tới 5 tuổi. Pfizer cho biết trong một tuyên bố rằng công ty dự kiến có đầy đủ số liệu vào đầu tháng Tư.
Giám đốc vaccine của FDA, Tiến sĩ Peter Marks cho biết ông hy vọng các bậc cha mẹ sẽ hiểu rằng quyết định của cơ quan này là một phần trong quá trình xem xét khoa học cẩn trọng về các bằng chứng mà Pfizer đã gửi cho đến nay.
Tiến sĩ Jesse Goodman của Đại học Georgetown, cựu giám đốc vaccine của FDA cho biết: “Tôi nghĩ họ đã đưa ra quyết định đúng đắn khi cẩn thận và chờ đợi dữ liệu về liều thứ ba.
Công ty sản xuất vaccine Pfizer cho biết hồi cuối tháng 12/2021 rằng nghiên cứu sơ bộ của công ty cho thấy hai mũi vaccine an toàn và đủ mạnh, bảo vệ tốt cho trẻ từ sơ sinh tới dưới 6 tháng tuổi. Nhưng với trẻ ở tuổi mẫu giáo - 2 đến 4 tuổi - hai liều không đủ bảo vệ. Theo nghiên cứu của Pfizer, cần phải tiêm mũi thứ ba cho nhóm tuổi này.
Cách đây vài tuần, FDA đã thúc giục Pfizer và đối tác BioNTech của mình tiến hành nộp hồ sơ để xem xét việc tiêm mũi thứ 3 cho trẻ dưới 5 tuổi. Vào tuần tới, các cố vấn khoa học độc lập của cơ quan sẽ tranh luận công khai xem liệu có thể bắt đầu tiêm hai mũi trước khi có bằng chứng rằng một mũi thứ ba sẽ mang lại cho họ sự bảo vệ cần thiết hơn - một động thái rất bất thường, theo quan điểm của hãng tin AP.
Thứ sáu, FDA đột ngột hủy bỏ cuộc họp đó, hứa sẽ tổ chức một khi Pfizer nộp bằng chứng liều thứ ba. Ngay cả khi Pfizer hoàn thành việc đệ trình vào đầu tháng 4, FDA và các cơ quan y tế khác sẽ phải mất vài tuần để xem xét và kiểm tra công khai dữ liệu.
Đầu tuần này, Giám đốc bộ phận vaccine của FDA đã hứa với cơ quan này sẽ không cắt giảm các tiêu chuẩn xem xét nhưng cũng lưu ý rằng đại dịch đang thay đổi nhanh chóng như thế nào.
Thanh Đoàn